Inspektions-Report der EMA
In dem kürzlich veröffentlichen 16. jährlichen Report der IWG (Inspector’s Working Group) listet die Europäische Arzneimittelbehörde EMA Verstöße (Findings) aus 67 von ihr beauftragten Behördeninspektionen im Jahr 2023 auf. Davon waren 58 Routineinspektionen. Insgesamt wurden 46 Prüfzentren inspiziert.

In diesem Beitrag möchten wir Ihnen einen Überblick zu den häufigsten Findings an den Prüfzentren geben.
Von den insgesamt 448 Verstößen wurden 15 (3 %) als kritisch (critical), 193 (43 %) als schwerwiegend (major) sowie 240 (54 %) als geringfügig (minor) eingestuft. Im Vergleich dazu wurden im Jahr davor noch 2 % als critical, 48 % als major und 50 % als minor klassifiziert.
Damit ist eine leichte Abnahme der schwerwiegenden und kritischen Findings zu verzeichnen. Die Art der jeweiligen Auffälligkeiten blieb dabei ähnlich.
Wir haben Ihnen die im Jahr 2023 festgestellten Verstöße der inspizierten Prüfzentren aufbereitet:
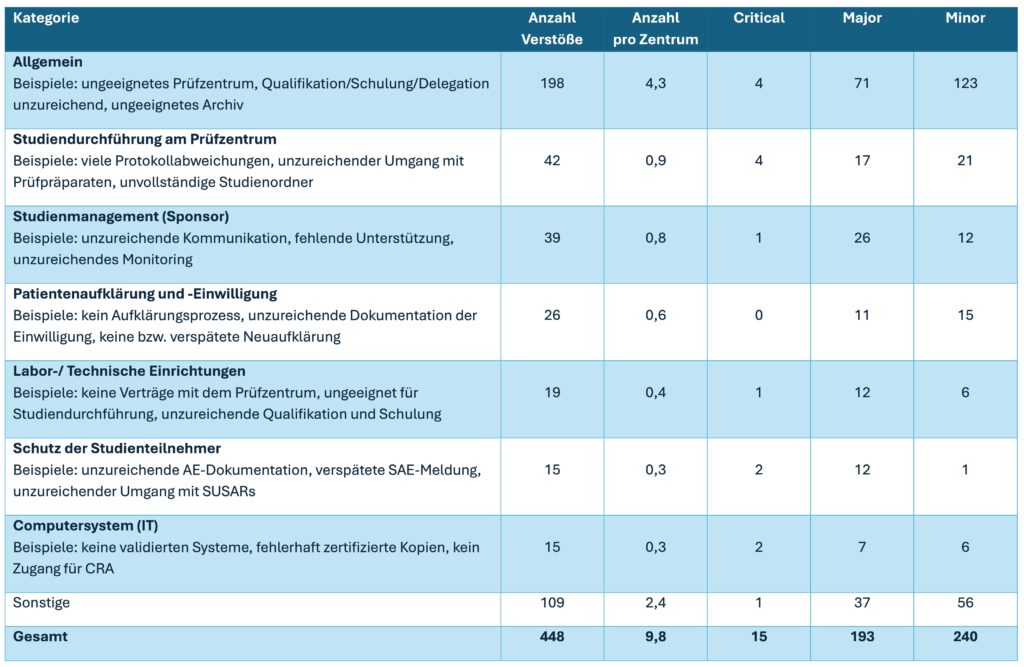
Bei dieser Analyse zeigt sich, dass sich die festgestellten Probleme über die Jahre kaum verändert haben, sie sollten also allen Beteiligten (Prüfteams, Service Provider, Sponsoren) bekannt sein.
Trotzdem wurden bei jedem Prüfzentrum im Schnitt 9,8 Findings registriert, davon 4,5 kritische oder schwerwiegende.
Kritische sowie mehrere schwerwiegende Verstöße können gravierende Folgen für die Auswertung der Prüfungsdaten sowie die weitere Durchführung am Prüfzentrum haben.
So kann im schlimmsten Fall ein Prüfzentrum auch aus der Studie genommen werden. Auch eine negative Einstufung bei den Ethikkommissionen bzw. den Sponsoren (CRO) ist möglich und kann dazu führen, dass das jeweilige Prüfzentrum keine weiteren Studienprojekte mehr durchführen darf oder direkt zu Beginn erneut inspiziert wird.
Serious Breaches
Bei klinischen Prüfungen mit Arzneimitteln nach EU (VO) 536/2014 (CTR) sind Sponsoren bei Kenntnisnahme von schwerwiegende Verstößen gegenüber der CTR bzw. dem Prüfplan (Serious Breaches) verpflichtet, diese umgehend an die zuständigen Behörden zu melden. Daraus kann ebenfalls eine Behördeninspektion am Prüfzentrum resultieren.
Was können Sie tun?
Kritische sowie schwerwiegende Findings lassen sich durch Beachtung folgender Punkte vermeiden:
1. Passendes Studienprojekt auswählen
Nehmen Sie den Site Selection Prozess des Sponsors ernst und wählen Sie nur für Sie durchführbare Studien aus. Nutzen Sie die Erfahrung Ihres Prüfteams und fragen Sie frühzeitig die vollständigen Informationen zum Studienprojekt beim Sponsor an. Im Zweifelsfall warten Sie lieber ab. Eventuell ist eine spätere Teilnahme möglich.
2. Studienstart vorbereiten
Spätestens beim Studienstart (Site Initiation Visit) sollte das Prüfzentrum vorbereitet sein. Was bedeutet das?
- Das gesamte Prüfteam ist geschult
- Die Studienaufgaben sind klar beschrieben und delegiert
- Die notwendige Infrastruktur ist vorhanden. Denken Sie hierbei auch an externe Einrichtungen wie z. B. das Kliniklabor.
Dadurch vermeiden Sie von Beginn an Fehler in der Studiendurchführung.
3. Investigator Oversight
Etablieren Sie geeignete Prozesse, um die Studiendurchführung zu überwachen. Ein Qualitätsmanagement mit geeigneten SOPs ist für die Durchführung komplexer klinischer Prüfungen essenziell.
4. Kommunikation mit dem Sponsor
Stellen Sie einen steten Kontakt mit dem Sponsor (CRO) sicher. Fragen Sie nach einem regelmäßigen klinischen Monitoring durch qualifizierte CRAs. Holen Sie dabei umfassendes Feedback ein, z. B. durch Gesprächsangebote und Follow-up-Letter. Wichtig: Dokumentieren Sie die relevante Kommunikation immer im Studienordner.
5. Einbindung weiterer Stellen (Service Provider)
Nutzen Sie die vorhandene Expertise an Ihrer Institution wie z.B. Qualitätsmanagement-Beauftragte, Datenschutz-Beauftragte, Rechtsabteilung oder auch Externe wie z. B. „Flying Study Nurse“.

Fazit
Hauptprüfer in klinischen Prüfungen sollten sich immer ihrer Verantwortung bewusst sein und für eine Studiendurchführung gemäß den geltenden Regularien, Verträgen und dem Prüfplan sorgen (Investigator Oversight). Dazu gehört es auch, geeignete Unterstützung durch den Sponsor (CRO) einzufordern bzw. zusätzliche Service Provider zu beauftragen. So können auftretende Schwierigkeiten frühzeitig erkannt und korrigiert werden und angekündigte Audits und Inspektionen sind weniger stressig für Sie und Ihr Team. Nehmen Sie diese Überprüfungen als externes Feedback und Chance zur Verbesserung wahr.
Gefällt Ihnen dieser Blog-Beitrag?
GCP & more ist Ihr Anbieter für GCP-Kurse und Beratungsdienstleistungen für das Studienpersonal im Bereich klinischer Studien. Erfahren Sie bei uns, was gute klinische Praxis ausmacht und für Sie am Studienzentrum wichtig ist. Wir verfügen über viele Jahre Erfahrung in der Pharmaindustrie und können auf ein umfangreiches Netzwerk zurückgreifen.
Wollen Sie mehr erfahren oder haben Sie Fragen rund um Ihr Studienprojekt? Dann buchen Sie einen kostenlosen Termin zur GCP-Beratung mit unserem Clinical Trial and Training Expert, Uwe Ramspott.

Unsere GCP-Kurse mit Terminen finden Sie hier:
