
Die erfolgreiche Durchführung klinischer Prüfungen am Prüfzentrum hängt maßgeblich davon ab, ob das Prüfzentrum tatsächlich für das jeweilige Studienprojekt geeignet ist.
Diese Eignung (Site Suitability) wird vor Studienbeginn sowohl durch den Sponsor bzw. einer CRO (Site Feasibility) als auch durch die zuständige Ethikkommission (Ethikvotum) überprüft. Worauf dabei geschaut wird, hatten wir kürzlich in unserem Beitrag Eignung als Prüfzentrum beschrieben.
Trotzdem passiert es immer wieder, dass die klinische Prüfung nicht wie gewünscht durchgeführt wird, weil z. B. das Prüfteam zu klein bzw. unzureichend qualifiziert ist oder die vereinbarte Anzahl von Studienteilnehmern nicht rekrutiert werden kann. In der neuen GCP-Leitlinie (ICH E6 R3) sind viele Punkte diesbezüglich überarbeitet und festgelegt worden.
In diesem Beitrag beschreiben wir den groben Ablauf der Zentrumsauswahl, stellen die wichtigsten Auswahlkriterien vor und geben Ihnen Hilfestellung bei der Auswahl der für Sie geeigneten Studienprojekte.
Auswahlprozess des Sponsors
Wenn man sich den gesamten Planungs- und Auswahlprozess des Sponsors ansieht, kann man zwei Abschnitte, vor bzw. nach der Prüfzentrenauswahl, erkennen.
1. Von der Studienidee bis zur Prüfzentrenauswahl

Nachdem der Sponsor die groben Rahmenbedingungen, z. B. Studienziele, Population, Zeiträume und Budget festgelegt hat, wird er ein (vorläufiges) Studienprotokoll erstellen. Mit dieser Prüfplan-Synopse wird dann ein Auftragsforschungsunternehmen (Service Provider, CRO) beauftragt, welches in der Regel geeignete Prüfzentren sucht. Das heißt, weder die CRO noch die Prüfzentren kennen zu diesem Zeitpunkt das finale Protokoll.
2. Von der Prüfzentrenauswahl bis zur Genehmigung

Während und nach der Auswahl (vorläufiger) Prüfzentren erstellt der Sponsor in Zusammenarbeit mit seinen Service Providern (CRO, Labor, Vendoren) die notwendigen Studiendokumente (Essential Records) und finalisiert das Studienprotokoll. In dieser Zeit werden auch die Prüferverträge verhandelt.
Eventuell findet noch ein zweiter Auswahlprozess der Prüfzentren (Site Qualification) statt. Ist alles fertig, wird die klinische Prüfung bei den Behörden (inkl. Ethikkommissionen) eingereicht. Nach Genehmigung und Freigabe durch den Sponsor kann die Studie begonnen werden (Site Initiation). Der gesamte Prozess kann ein Jahr oder länger dauern und sich in dieser Zeit vieles ändern.
In dieser Zeit erhalten die Prüfzentren in der Regel kein Studienhonorar. Das heißt, die durchgeführten Vorbereitungsmaßnahmen werden nicht vergütet. Dies kann jedoch im Prüfervertrag vereinbart werden (z. B. Start-up-Fee).
Kriterien zur Prüfzentrumseignung (Site Suitability)
Folgende Anforderungen müssen vom Prüfzentrum erfüllt werden:
- Auswahlkriterien des Sponsors
- Bewertungskriterien der Ethikkommission
- Anforderungen nach ICH-GCP (R3)

1. Auswahlkriterien des Sponsors
Aus Sicht der Sponsoren macht ein gutes Prüfzentrum folgendes aus:
- Ausreichend fachkundiges Studienpersonal mit Zeit für die Studiendurchführung
- Erreichbarer Hauptprüfer
- Engagement des Prüfteams
- Realistische Einschätzung zur Rekrutierung von Studienteilnehmern
- Geeignete Rekrutierungsmaßnahmen
- Gute Studiendokumentation
- Entsprechende Infrastruktur, IT
- Klare Prozesse (SOP), Qualitätsmanagement
- Validierung von elektronischen Patientenakten
- Gute Kommunikation, Kritikfähigkeit
- Kurze Zeit für Vertragsabschluss
- Klinikleitung muss Studienzentrum unterstützen
Die Kriterien werden häufig durch einen Feasibility-Fragebogen erhoben sowie in einem Pre-Study-Visit (Selection Visit) besprochen.
2. Bewertungskriterien der Ethikkommission
Notwendige Angaben im Site Suitability Form (Qualifikationsnachweis):
- Qualifizierte Hauptprüfer und Prüfer (CV, GCP-Zertifikat)
- Ausreichend großes und qualifiziertes Prüfteam
- Genügend Zeit zur Studiendurchführung
- Geeignete Prozesse (SOP)
- Infrastruktur
- Ausreichend Studienteilnehmer
Möchte der Sponsor mit dem Prüfzentrum zusammenarbeiten, wird das Site Suitability Form erstellt und vom Sponsor im Ethikantrag eingereicht. Eine Ablehnung durch die zuständige Ethikkommission sollte die Ausnahme sein.
3. Weitere Anforderungen nach ICH-GCP (R3)
Durch die neue GCP-Revision (R3) sollen folgende Punkte klar zwischen dem Sponsor (CRO) und dem Prüfzentrum vereinbart sein:
- Geschultes Prüfteam
- Klare Aufgabendelegation
- Lagerung Studienmedikation
- Dokumentenmanagement
- Validierte elektronische Systeme
- Archivierung nach Studienende
- Kommunikation mit Service Providern und Sponsor
Gerade bei der Beteiligung externer Einrichtungen (z. B. Klinikapotheke, Pathologie) oder der Teilnahme an dezentralisierten klinischen Prüfungen (DCT) sollten beiden Seiten die Mitglieder des Prüfteams und der Umfang der Verantwortung des Hauptprüfers (Investigator Oversight) bekannt sein.
Auswahlprozess des Prüfzentrums
Wie zuvor beschrieben, passiert es trotz des umfangreichen Feasibility-Prozesses des Sponsors und der Überprüfung der Zentrumseignung durch die Ethikkommission, dass die klinische Prüfung scheitert bzw. mehrfach verlängert wird. So schaffen nur die wenigsten Prüfzentren das vereinbarte Rekrutierungsziel oder es kommt zu vielen Verstößen gegenüber den Regularien bzw. dem Protokoll. Es gibt dafür zwar viele Gründe, entscheidend ist jedoch, dass die klinische Prüfung bzw. der Sponsor (CRO) wirklich zum jeweiligen Prüfzentrum passt. Lesen Sie hierzu auch unseren Beitrag zur Inspection Readiness.

Fragt man Prüfzentren, so stören diese in der Zusammenarbeit mit dem Sponsor (CRO) unter anderem folgende Punkte:
- Unvollständige Machbarkeitsanalyse bei der Studienauswahl
- Der Aufwand ist vorher nicht klar. Nur Protokoll-Synopse wird zur Verfügung gestellt
- Fehlende Einbindung in den Prüfplan
- Fehlende Planbarkeit der Finanzierung
- Verfügbarkeit von qualifiziertem Personal beim Sponsor (CRO)
- Unzureichend, qualifizierte CRAs, schlechte Schulung
- Zu viele Remotevisits, zu wenig Onsite-Monitoring
Dies lässt sich auf zwei Themenbereiche reduzieren:
- Unzureichende Information zum Umfang und zur genauen Durchführung der klinischen Prüfung
- Unzureichender Support durch den Sponsor (CRO), z. B. durch qualifiziertes Monitoring während der Studie
Beides lässt sich durch einen separaten Auswahlprozess auf Seiten des Prüfzentrums klären bzw. reduzieren.
Folgende Punkte sollten Sie im Vorfeld genau besprechen:
- Alle durchzuführenden Studienmaßnahmen
- Sponsor-Anforderungen
- Umfang des Investigator Oversight
- Zusammenarbeit, Kommunikation
- Honorierung
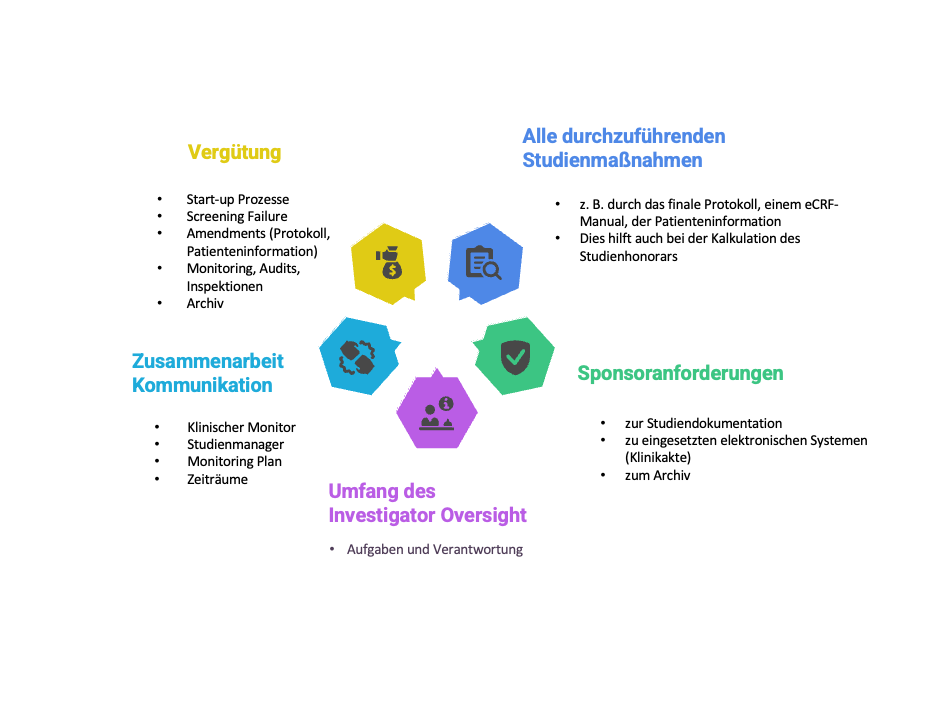
Das alles sollte nach ICH-GCP (R3) vom Sponsor geplant und vorbereitet sein.
Fazit
Für eine erfolgreiche Studiendurchführung sollte der Auswahlprozess der klinische Prüfung bzw. des Prüfzentrums von den Prüfzentren aktiv begleitet werden. Wählen Sie nur die für Sie passenden klinischen Studien aus. Lassen Sie sich dabei unterstützen (z. B. durch das QM-Team oder durch Ihre Studienzentrale). Gerade durch die neue GCP-Version (ICH E6 R3) wird sich vieles bezüglich der Planung und Vorbereitung klinischer Prüfungen ändern. Nutzen Sie jetzt die Gelegenheit, geeignete Strukturen aufzubauen und sich entsprechend zu positionieren.
GCP & more ist Ihr Anbieter für GCP-Kurse und Beratungsdienstleistungen für das Studienpersonal im Bereich klinischer Studien. Erfahren Sie bei uns, was gute klinische Praxis ausmacht und für Sie am Studienzentrum wichtig ist. Wir verfügen über viele Jahre Erfahrung in der Pharmaindustrie und können auf ein umfangreiches Netzwerk zurückgreifen.
Wollen Sie mehr erfahren oder haben Sie Fragen rund um Ihr Studienprojekt? Dann buchen Sie einen kostenlosen Termin zur GCP-Beratung mit unserem Clinical Trial and Training Expert, Uwe Ramspott.

Unsere GCP-Kurse mit Terminen finden Sie hier:
